ΠΩΣ ΦΤΙΑΧΝΕΤΑΙ ΕΝΑ ΦΑΡΜΑΚΟ
Για να δημιουργηθεί ένα νέο φάρμακο χρειάζεται τουλάχιστον μια δεκαετία δουλειάς. Το κόστος αγγίζει το 1 δισ. δολάρια και το 90% των σκευασμάτων που δημιουργούνται «κόβονται» στις κλινικές δοκιμές. Υπάρχει πιο αποτελεσματικός τρόπος;
Όποιο φάρμακο βλέπεις στα ράφια των φαρμακείων, χρειάστηκε δέκα με δεκαπέντε χρόνια για να φτάσει εκεί, από την στιγμή που άρχισε η έρευνα για τη δημιουργία του. Χρειάστηκε επίσης περίπου 1 δισεκατομμύριο δολάρια. Τέτοιο είναι το κόστος της διαδικασίας, με το 90% των περιπτώσεων να καταλήγουν στον κάλαθο των αχρήστων.
Γιατί το 90% των υποψήφιων φαρμάκων αποτυγχάνουν στις κλινικές δοκιμές, είτε γιατί δεν αντιμετωπίζουν επαρκώς την πάθηση για την οποία προορίζονταν, είτε επειδή οι παρενέργειες είναι πολύ ισχυρές για να τις αντέξουμε.
Πώς ξεκινούν όλα για να δημιουργηθεί ένα φάρμακο
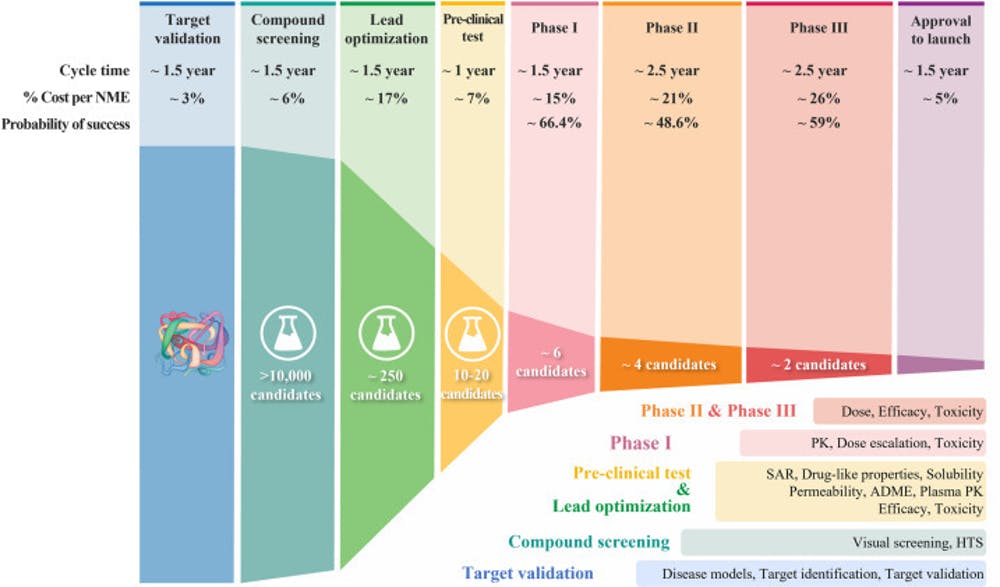
Για να φτάσουν οι ερευνητές στις κλινικές δοκιμές, πρέπει προηγουμένως να έχουν ερευνήσει κάτι. Αποφασίζουν τι θα ερευνήσουν, μέσω της κλασικής διαδικασίας – όπως ονομάζεται. Δηλαδή, βρίσκουν ένα μοριακό στόχο που προκαλεί ασθένεια, π.χ. μια υπερπαραγόμενη πρωτεΐνη που, εάν αποκλειστεί, θα μπορούσε να βοηθήσει να σταματήσει η ανάπτυξη των καρκινικών κυττάρων. Όλο αυτό κρατάει γύρω στον ενάμιση χρόνο.
Στη συνέχεια, εξετάζουν ό,τι υπάρχει σε χημικές ενώσεις, ώστε να εντοπίσουν πιθανούς υποψηφίους που μπορούν να «νικήσουν» τον μοριακό στόχο. Γι’ αυτό χρειάζονται άλλον ενάμιση χρόνο.
Μόλις βρουν κάτι που φαίνεται πολλά υποσχόμενο, περνούν στις εργαστηριακές δοκιμές, για τη βελτιστοποίηση της ικανότητας του εκάστοτε φαρμάκου να προσεγγίζει τα άρρωστα μέρη του σώματος –τον στόχο– σε επαρκή επίπεδα, αποφεύγοντας τα υγιή μέρη του σώματος. Και πάλι το διάστημα των δοκιμών πλησιάζει στα δύο χρόνια.
Στις δοκιμές, το πρώτο ζητούμενο είναι να διαπιστωθεί αν το υποψήφιο φάρμακο μπορεί να μπλοκάρει ουσιαστικά τον μοριακό στόχο, χωρίς να επηρεάζει ό,τι δεν το αφορά. Για να βελτιστοποιήσουν την ισχύ και την εξειδίκευση, οι επιστήμονες επικεντρώνουν στο πώς η χημική δομή της ένωσης καθορίζει τη δραστηριότητα της στο σώμα μας.
Το δεύτερο ζητούμενο είναι να μπορεί να απορροφάται και να μεταδίδεται μέσω του αίματος φτάνοντας στον επιδιωκόμενο στόχο, δηλαδή στα όργανα που έχουν προσβληθεί. Όταν οι ερευνητές κρίνουν πως αυτό που έχουν στα χέρια του πληροί τα κριτήρια, προχωρούν σε δοκιμές αποτελεσματικότητας και ασφάλειας. Το διάστημα συνήθως είναι ένας χρόνος.
Οι δοκιμές γίνονται αρχικά σε ζώα και μετά σε ανθρώπους. Οι δοκιμές που γίνονται σε ανθρώπους λέγονται κλινικές δοκιμές.
Από τις μελέτες στις κλινικές δοκιμές και την κλινική έρευνα
Οι κλινικές μελέτες απαντούν σε βασικά ερωτήματα σχετικά με την ασφάλεια ενός φαρμάκου. Δεν υποκαθιστούν τις μελέτες των τρόπων αλληλεπίδρασης του φαρμάκου με το ανθρώπινο σώμα. Γι’ αυτό απαιτούνται μελέτες ή δοκιμές που γίνονται σε ανθρώπους. Όταν οι επιστήμονες σχεδιάζουν μια κλινική δοκιμή, λαμβάνουν υπόψη τι θέλουν να επιτύχουν σε καθεμία από τις τρεις διαφορετικές φάσεις που έχει η κλινική έρευνα. Μόλις είναι διαθέσιμα τα στοιχεία, αρχίζει η Διαδικασία Διερεύνησης Νέου Φαρμάκου (Investigational New Drug Process – IND).
Η κλινική δοκιμή ξεκινά με την υποβολή αίτησης από αυτούς που φτιάχνουν ένα φάρμακο ή τους χορηγούς τους. Στην αίτηση καλούνται να αναφέρουν πληροφορίες για:
- δεδομένα τοξικότητας (παρενέργειες που προκαλούν μεγάλη βλάβη) και μελετών σε ζώα,
- κατασκευαστικές πληροφορίες,
- κλινικά πρωτόκολλα (σχέδια μελέτης) για όσα θα ακολουθήσουν,
- δεδομένα από οποιαδήποτε προηγούμενη μελέτη έχει γίνει σε ανθρώπους και
- πληροφορίες για τον ερευνητή.
Εφόσον το FDA δώσει έγκριση, περνά στην πράξη ο σχεδιασμός των κλινικών δοκιμών που έχει ως στόχο να απαντήσει σε συγκεκριμένα ερευνητικά ερωτήματα, σχετικά με τη νέα ουσία. Ακολουθείται συγκεκριμένο σχέδιο μελέτης, που λέγεται «πρωτόκολλο» και αναπτύσσεται από τον ερευνητή. Πριν ξεκινήσει η όποια κλινική δοκιμή, οι ερευνητές εξετάζουν προηγούμενες πληροφορίες που αφορούν το φάρμακο, ώστε να αναπτύξουν ερευνητικά ερωτήματα και στόχους.
Μέσω αυτής της διαδικασίας αποφασίζουν:
- Ποιοι πληρούν τις προϋποθέσεις συμμετοχής (κριτήρια επιλογής).
- Πόσα άτομα θα πάρουν μέρος στη μελέτη.
- Πόσο καιρό θα διαρκέσει η μελέτη.
- Αν θα υπάρξει ομάδα ελέγχου και άλλοι τρόποι που θα περιορίσουν τυχόν προκατάληψη της έρευνας.
- Πώς θα χορηγείται το φάρμακο στους ασθενείς (ως χάπι, ενέσιμο κ.ά.) και ποια θα είναι η δόση.
- Ποιες αξιολογήσεις θα γίνουν, ποια δεδομένα θα συλλεχθούν και πότε.
- Πώς θα αναθεωρηθούν και θα αναλυθούν τα δεδομένα.
Οι φάσεις, όπως αναφέραμε, τις περισσότερες φορές είναι τρεις. Αν ένα νέο φάρμακο αποδειχθεί επιτυχημένο στην πρώτη φάση, περνά στη δεύτερη και ούτω καθεξής.
Φάση #1
Η πρώτη φάση της δοκιμής γίνεται σε γκρουπ λίγων υγιών εθελοντών ή ανθρώπων με ασθένεια για την οποία προορίζεται το φάρμακο (από 20 έως 100). Ο στόχος των μηνών που διαρκεί αυτή η φάση είναι να βρεθεί η ασφαλής δόση της νέας θεραπείας (να κάνει καλό, χωρίς να κάνει κακό), να διευκρινιστεί πώς είναι προτιμότερο να δίνεται (με ένεση, σε χάπι, σε ορό κ.ά.) και πώς επιδρά στο σώμα. Το 70% των φαρμάκων παίρνουν έγκριση για τη δεύτερη φάση.
Φάση #2
Στη δεύτερη φάση περνούν τα φάρμακα για τα οποία βρίσκεται η σωστή ποσότητα της δόσης και αφορά περισσότερους ανθρώπους (κάποιες εκατοντάδες). Σε διάστημα μηνών έως δύο χρόνων οι καθ’ ύλην αρμόδιοι επικεντρώνονται στις συνέπειες που έχει η ουσία στο σώμα και πώς επιδρά σε συγκεκριμένους τύπους της πάθησης (π.χ. διαφορετικούς τύπους καρκίνου). Εάν διαπιστωθεί ότι είναι ασφαλής και έχει οφέλη, περνάει στην τρίτη φάση. Το ποσοστό των επιτυχόντων είναι κάπου στο 33%.
Φάση #3
Το τελευταίο στάδιο των κλινικών δοκιμών χρειάζεται από 300 έως 3000 ανθρώπους και διαρκεί από 1 έως 4 χρόνια. Ο στόχος είναι να συγκριθεί το νέο φάρμακο με τα ήδη υπάρχοντα, ώστε να διαπιστωθεί ποιο είναι καλύτερο. Αν το νέο φάρμακο είναι καλύτερο, ο φάκελος πηγαίνει στον αμερικανικό οργανισμό τροφίμων και φαρμάκων (Food and Drug Administration – FDA), για έγκριση.
Η ομάδα της αρχής κάνει ενδελεχή εξέταση όλων των πληροφοριών που υπάρχουν στον φάκελο και αποφασίζει αν θα εγκρίνει ή θα απορρίψει. Το διάστημα ελέγχου κρατά κατά μέσο όρο ενάμιση χρόνο και το ποσοστό έγκρισης είναι στο 5%. Το FDA επανέρχεται για άλλο έλεγχο, μετά την κυκλοφορία.
Από στάδιο σε στάδιο μειώνεται το ποσοστό της επιτυχίας.
Μόνο το ένα στα 10 υποψήφια φάρμακα περνούν τις κλινικές δοκιμές και την εξέταση του FDA
Ο Duxin Sun, καθηγητής φαρμακευτικών επιστημών στο University of Michigan, με χρόνια προϋπηρεσίας στην ανάπτυξη φαρμάκων, αποκάλυψε ότι το 90% των φαρμάκων που φτάνουν στις κλινικές δοκιμές μένουν εκεί.
Το εργαστήριό του προσπαθεί να βρει τρόπους να κάνει πιο απλή, πιο οικονομική και πιο αποτελεσματική τη διαδικασία. Τόνισε ότι «αρχής γενομένης από τα πρώτα στάδια εξέλιξης και το πώς οι ερευνητές επιλέγουν υποψήφια πιθανά φάρμακα, υπάρχουν πολλές αλλαγές που μπορούν να έχουν ως συνέπεια καλύτερα ποσοστά επιτυχίας και τελικά, καλύτερα φάρμακα».
Σχετική ανάλυση που έγινε το 2016 εντόπισε τέσσερις πιθανούς λόγους για το χαμηλό ποσοστό επιτυχίας.
- Ποσοστό μεταξύ του 40% και του 50% των αποτυχιών οφείλονταν σε έλλειψη κλινικής αποτελεσματικότητας. Δηλαδή, το φάρμακο δεν ήταν σε θέση να παράγει το επιδιωκόμενο αποτέλεσμα, κατά τη δοκιμή του στους ανθρώπους.
- Περίπου το 30% των αποτυχιών οφείλονταν σε μη διαχειρίσιμη τοξικότητα ή παρενέργειες.
- Το 10% με 15% είχε να κάνει με την αδυναμία απορρόφησης του φαρμάκου από τον οργανισμό.
- Το τελευταίο 10% των αποτυχιών αποδόθηκε σε έλλειψη εμπορικού ενδιαφέροντος και κακό στρατηγικό σχεδιασμό.
Ο Dr. Sun εξηγεί ότι μεταξύ των ερωτημάτων που εγείρονται είναι αν ένας επιλεγμένος μοριακός στόχος είναι ο καλύτερος δείκτης για τον έλεγχο των φαρμάκων και αν η διαδικασία βελτιστοποίησης οδηγεί στους καλύτερους υποψηφίους προς επιλογή για περαιτέρω δοκιμές.
Πρόσθεσε ότι συχνά ο στόχος που προορίζεται να «χτυπήσει» το νέο φάρμακο επηρεάζεται σε χαμηλές συγκεντρώσεις, κάτι που μπορεί να αποδειχθεί εις βάρος της διασφάλισης ότι θα φτάσει αρκετή ποσότητα στα σωστά μέρη του σώματος – και δεν θα προκληθεί βλάβη στον υγιή ιστό. «Η ερευνητική μου ομάδα και εγώ πιστεύουμε ότι αυτή η μη ισορροπημένη διαδικασία βελτιστοποίησης φαρμάκων μπορεί να “παραμορφώσει” την επιλογή των υποψήφιων φαρμάκων και να επηρεάσει την τελική τους απόδοση στις κλινικές δοκιμές».
ΑΚΟΜΗ ΚΑΙ ΜΕΤΡΙΕΣ ΒΕΛΤΙΩΣΕΙΣ ΣΤΗ ΔΙΑΔΙΚΑΣΙΑ ΑΝΑΠΤΥΞΗΣ ΝΕΩΝ ΦΑΡΜΑΚΩΝ ΙΣΩΣ ΜΕΙΩΣΟΥΝ ΤΟ ΚΟΣΤΟΣ ΑΛΛΑ ΚΑΙ ΤΟΝ ΧΡΟΝΟ ΠΟΥ ΑΠΑΙΤΕΙΤΑΙ ΓΙΑ ΤΗΝ ΕΥΡΕΣΗ ΜΙΑΣ ΘΕΡΑΠΕΙΑΣ.
Οι μηχανές στην υπηρεσία των ασθενών
Ο επιστήμονας διευκρίνισε πως τις τελευταίες δεκαετίες έχουν αναπτυχθεί και εφαρμοστεί πολλά επιτυχημένα εργαλεία και στρατηγικές βελτίωσης, για κάθε βήμα της διαδικασίας ανάπτυξης φαρμάκων. Ανάμεσά τους περιλαμβάνεται έλεγχος υψηλής απόδοσης, με ρομπότ να αναλαμβάνουν την αυτοματοποίηση εκατομμυρίων δοκιμών στο εργαστήριο.
Έτσι, επιταχύνεται η διαδικασία εντοπισμού πιθανών υποψήφιων, γίνεται σχεδιασμός φαρμάκων βάσει τεχνητής νοημοσύνης, εφαρμόζονται νέες προσεγγίσεις για την πρόβλεψη και τον έλεγχο της τοξικότητάς τους, και γίνεται ακριβέστερη επιλογή ασθενών για τις κλινικές δοκιμές. «Παρ’ όλα αυτά, το ποσοστό επιτυχίας δεν έχει αλλάξει πολύ. Γι’ αυτό και πιστεύουμε ότι η διερεύνηση νέων στρατηγικών –που να επικεντρώνονται στα πρώτα στάδια ανάπτυξης φαρμάκων, όταν οι ερευνητές επιλέγουν πιθανές ενώσεις– μπορεί να συμβάλει στην αύξηση της επιτυχίας. Αυτό είναι κάτι που θα μπορούσε να γίνει με τη βοήθεια της τεχνολογίας, όπως με το εργαλείο επεξεργασίας γονιδίων CRISPR, που μπορεί να επιβεβαιώσει πιο αυστηρά τον σωστό μοριακό στόχο που προκαλεί μια ασθένεια και εάν το όποιο φάρμακο βρίσκει πραγματικά το στόχο».
Ο Dr. Sun έθεσε και το θέμα ρεαλιστικών προσδοκιών. «Το να φτάσει ένα υποψήφιο φάρμακο στο στάδιο της κλινικής δοκιμής είναι μεγάλη υπόθεση, για κάθε φαρμακευτική εταιρεία ή ακαδημαϊκό ίδρυμα που αναπτύσσει νέα φάρμακα. Και είναι τεράστια απογοήτευση να οδηγούνται τόσα υποψήφια φάρμακα σε αποτυχία, μετά χρόνια προσπάθειας και μεγάλες επενδύσεις. Αν και η φύση της ανάπτυξης φαρμάκων μπορεί να μην καθιστά εύκολο το 90% για ποσοστό επιτυχίας, πιστεύουμε ότι ακόμη και μέτριες βελτιώσεις μπορούν να μειώσουν σημαντικά το κόστος και τον χρόνο που απαιτείται για την εύρεση θεραπείας για πολλές ανθρώπινες ασθένειες».